Ariel Sánchez
A) La osteoporosis se define como un desorden esquelético caracterizado por una menor fortaleza ósea, que predispone a tener fracturas. La resistencia ósea refleja la integración de 2 características principales: densidad y calidad óseas. La densidad ósea se expresa en gramos de mineral por área o por volumen, y en un individuo cualquiera está determinada por el pico de masa ósea alcanzado y por la cantidad de hueso perdido después. La calidad se refiere a la arquitectura, el recambio, la acumulación de daños (p. ej. microfracturas) y la mineralización. Una fractura ocurre cuando una fuerza (trauma) se aplica sobre un hueso osteoporótico. Por eso la osteoporosis es un importante factor de riesgo de fracturas, y debe hacerse un distingo entre factores de riesgo de osteoporosis y factores de riesgo de fracturas.
B) Es importante corregir el error conceptual común de que la osteoporosis siempre proviene de la pérdida de masa ósea. La pérdida de tejido óseo ocurre habitualmente a medida que hombres y mujeres envejecen; sin embargo, un sujeto que no alcanza una masa ósea óptima durante la niñez y la adolescencia puede desarrollar osteoporosis sin que haya ocurrido una pérdida acelerada de hueso. De aquí que un desarrollo subóptimo de hueso en durante el crecimiento es tan importante como la pérdida de hueso en la génesis de la osteoporosis.
C) Por el momento no hay una medida exacta de la resistencia ósea en general. La densidad mineral ósea (DMO) se usa frecuentemente como una medición sustitutiva, ya que permite explicar aproximadamente 70% de la resistencia ósea. La OMS da una definición operacional de osteoporosis como “una DMO 2,5 desvíos estándar (DE) por debajo de la media de mujeres blancas, adultas jóvenes” (20-30 años). No está claro cómo se aplica este criterio diagnóstico a varones, niños y otros grupos étnicos. Debido a la dificultad para lograr mediciones exactas y una estandarización entre distintos instrumentos (llamados densitómetros) y diferentes sitios anatómicos de medición (columna vertebral, cadera, antebrazo distal, falanges o metacarpianos, tibia, calcáneo, etc.), existen controversias entre expertos con respecto a la vigencia de este criterio diagnóstico. Columna y cadera se consideran sitios “axiales” o “centrales” y los demás sitios se denominan “periféricos”.
D) La osteoporosis puede clasificarse como primaria o secundaria. La primaria puede ocurrir en ambos sexos a cualquier edad, pero con frecuencia se da después de la menopausia en mujeres, y más tarde en la vida también en hombres. La secundaria es el resultado de medicaciones u otras enfermedades (p. ej. la osteoporosis inducida por glucocorticoides, el hipogonadismo, o la enfermedad celíaca).
E) Las fracturas osteoporóticas características son las que siguen a impactos de baja energía relativa (agacharse, levantar un objeto pesado, caídas desde baja altura, etc.). La incidencia de fracturas es alta en personas con osteoporosis y aumenta con la edad. La probabilidad de que un sujeto de raza blanca y 50 años de edad tenga una fractura de cadera durante el resto de su vida es de 14% para una mujer y 5-6% para un varón. Hay abundantes trabajos mostrando que los sujetos que sufren fracturas de cualquier tipo, cualquiera sea su edad y sexo, tienen menos DMO que testigos sanos. De modo que un antecedente fracturario debe despertar la sospecha de que existe una osteoporosis.
Fisiopatología
La pérdida progresiva de masa ósea a partir de los 40 años es un fenómeno casi fisiológico, que se da en ambos sexos, en todas las latitudes y en todas las razas, aunque es menos frecuente en los negros. Hay un 30% menos de masa ósea en ancianos (70-80 años) que en jóvenes (20-30 años), siendo menor en aquéllos el contenido cálcico del esqueleto.
El proceso puede afectar preferentemente al hueso trabecular o al hueso compacto, que se torna más “poroso”. En el hueso osteoporótico, la relación entre matriz mineralizada y matriz no mineralizada es normal. Dicho de otra manera, aunque disminuye el volumen de hueso, el que permanece está adecuadamente calcificado.
Hay en el tejido óseo tres poblaciones celulares bien definidas: los osteoblastos, ocupados en la aposición de nuevo hueso; los osteoclastos, especializados en la resorción ósea; y los osteocitos, células maduras que han perdido su capacidad para sintetizar hueso y que son capaces, en circunstancias especiales, de resorberlo. La formación y la resorción óseas son procesos continuados a lo largo de toda la vida, en lo que se conoce como la remodelación. Ésta ocurre en todas las superficies del hueso: la endóstica, la perióstica y la intracortical o haversiana. En general hay una estrecha relación entre formación y resorción. La presencia y el tipo de actividad en las superficies óseas puede demostrarse por diversas técnicas, que incluyen la evaluación cuantitativa de las clases celulares en secciones finas sin desmineralizar, microrradiografías de secciones gruesas mineralizadas, y fluorescencia de marcas de tetraciclina unidas a regiones de hueso recién mineralizado.
El equilibrio entre ganancia y pérdida de hueso probablemente se debe a la actividad coordinada de “paquetes” de células que interactúan en un volumen de hueso relativamente pequeño; es lo que Frost denominó “unidades multicelulares básicas”.
La mayor parte de las superficies óseas están, por lo general, inactivas. Datos morfométricos obtenidos a partir de biopsias de cresta ilíaca en adultos normales indican que la superficie de neoformación (cubierta con osteoide, o sea, hueso nuevo aún no calcificado) es un 10% de la superficie total, mientras que la superficie resortiva representa sólo un 2-4% del total. Estudios cinéticos con Ca47 indican que el pool de calcio (calcio en líquido extracelular y tejidos blandos, y calcio intercainbiable en hueso) es de aproximadamente 5 g. En adultos normales, 0,5 g de calcio entra y sale del hueso cada día. Puede calcularse que 1/6 del esqueleto se resorbe anualmente, para ser nuevamente repuesto.
La mineralización es el proceso por el cual el mineral inorgánico se deposita en la matriz orgánica. Como el mineral está compuesto por calcio y fósforo, la concentración de estos iones en el plasma y en el líquido extracelular influye en su formación. Es posible que los osteoblastos y los osteocitos puedan regular la concentración local de calcio y fósforo, y de otros factores importantes como el magnesio y el pH. El colágeno puede catalizar la nucleación de la fase mineral a partir de soluciones que contengan Ca y P. Sin embargo, se piensa que hay inhibidores capaces de regular la mineralización in situ. El pirofosfato inorgánico es un potente inhibidor de la calcificación. La fosfatasa alcalina, presente en los osteoblastos, puede catalizar la hidrólisis del pirofosfato, y quizás esta enzima tenga un papel en la regulación del depósito de sales minerales. El mineral recién depositado es amorfo, y su cociente molar Ca/P es relativamente bajo. Al madurar, se va convirtiendo en hidroxiapatita cristalina. Cuando en el líquido extracelular las concentraciones de calcio y fósforo son altas, puede depositarse mineral en tejidos que habitualmente no se calcifícan; por el contrario, si sus concentraciones son bajas, no puede formarse bien el mineral óseo.
El proceso de resorción no ha sido suficientemente aclarado, sobre todo en lo que respecta a la remoción de iones a partir de la matriz. Ésta es disuelta por colagenasas, pero tales enzimas no pueden degradar la proteína antes de que sea desprovista de la fase mineral.
Varias hormonas tienen profundos efectos sobre el crecimiento y la remodelación del hueso. La hormona paratiroidea (PTH) tiene influencias casi inmediatas sobre las células óseas, como la entrada de calcio a las mismas, la activación de la adenilciclasa con producción intracelular de monofosfato cíclico de adenosina, y la captación de uridina y de varios aminoácidos. Blanco preferido de la acción de esta hormona son los osteoclastos, pero sus efectos crónicos suponen, además de la estimulación de los osteoclastos preexistentes, la formación de otros nuevos. La PTH actúa también directamente sobre los osteoblastos, que tienen receptores específicos. Buena parte del efecto de PTH sobre los osteoclastos es mediada por los osteoblastos, que segregan, bajo el influjo de PTH, citoquinas con efecto sobre aquellas células.
Los metabolitos activos de la vitamina D, notablemente el 1,25-dihidroxicolecalciferol o calcitriol, son capaces también de aumentar la actividad y el número de osteoclastos; su acción resortiva es sinergística con la de la hormona paratiroidea.
La acción hipocalcemiante de la calcitonina fue conocida a poco de su descubrimiento, y parece deberse a efectos frenadores directos sobre los osteoclastos. La inhibición de la resorción ósea es de comienzo rápido, pero desaparece no bien se remueve la hormona. Después de la administración de calcitonina se han demostrado niveles aumentados de hormona paratiroidea, probablemente estimulados por el descenso del calcio plasmático.
Tanto los osteoblastos como los osteoclastos requieren la presencia de tiroxina para su función normal. La hipertiroxinemia aumenta tanto la formación como la resorción, y preferentemente la segunda.
Los glucocorticoides inhiben in vitro la trasformación de células precursoras en osteoclastos, disminuyendo así la respuesta resortiva del hueso a la hormona paratiroidea. In vivo, el exceso de estos esteroides estimula la resorción ósea, aunque éste quizás sea un efecto indirecto: como por una parte disminuyen la absorción intestinal de calcio y por otra aumentan la calciuria, inducen un balance cálcico negativo que puede llevar a un hiperparatiroidismo secundario. Por otro lado, los glucocorticoides inhiben la expresión de muchos factores de crecimiento con efecto anabólico sobre los osteoblastos; por eso, en la osteoporosis metacorticoidea la función osteoblástica está muy disminuida; los corticoides retardan el cierre de las fracturas.
| Tabla 78-1. Factores humorales de control de osteoblastos y osteoclastos | ||
|
Osteoblastos |
Osteoclastos |
|
|
Estimulan |
Tensión mecánica, calcitriol, esteroides sexuales, somatotrofina, factor de crecimiento insulino-símil 1, PTH |
Tiroxina, PTH, calcitriol, prostaglandinas, factor de necrosis tumoral-alfa, otras citokinas |
|
Inhiben |
Inmovilización, vejez, glucocorticoides |
Calcitonina, estrógenos, bifosfonatos |
Se conoce desde hace relativamente poco tiempo un sistema de señales entre las células óseas: existe un factor en la membrana de células de linaje osteoblástico que es inducido por factores estimulantes de la resorción (p. ej., la PTH). Este ligando, miembro de la superfamilia del factor de necrosis tumoral (TNF), se llama RANKL (ligando del receptor activador del factor nuclear kappa). Se une a un receptor altamente especifico, el RANK, proteína transmembrana expresada por los osteoclastos. La unión de este receptor con su ligando induce una cascada de eventos intracelulares que conducen a la diferenciación de células precursoras en osteoclastos y en la activación de los osteoclastos maduros. Además, los osteoblastos segregan un propéptido de 401 aminoácidos que, al dimerizarse, se activa y puede actuar como un receptor “señuelo”; se lo conoce como osteoprotegerina (OPG). Se trata de un receptor soluble, no ligado a la membrana celular, y que se interpone entre el RANK y el RANKL, impidiendo la interacción entre ellos y, por ende, inhibiendo la activación osteoclástica. Es decir que, para diferenciarse y madurar, las células de estirpe osteoclástica deben tener contacto directo con los osteoblastos. Cuanto más RANKL y menos OPG haya en un determinado microambiente, mayores serán el número y la actividad de los osteoclastos; y al revés, cuanto menos RANKL y más OPG estén presentes, habrá menos osteoclastos activos (ver fig. 79-1).
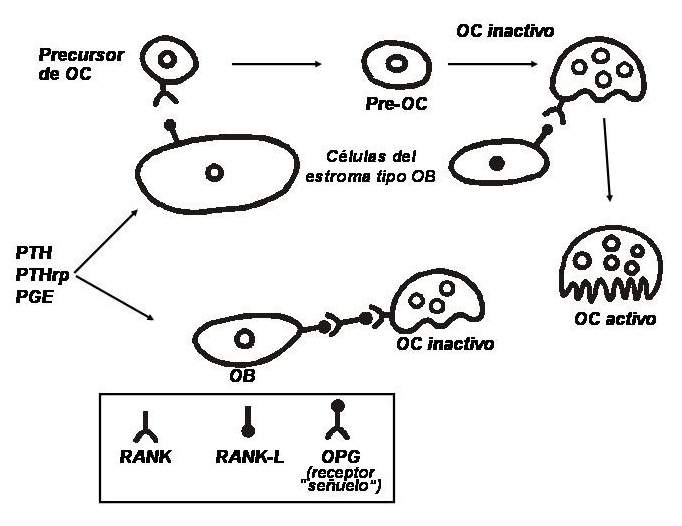
Sistema de regulación entre osteoblastos y osteoclastos. (Abreviaturas: OB, osteoblasto; OC, osteoclasto; OPG, osteoprotegerina; RANK, receptor activador del factor nuclear kappa; RANKL, ligando del RANK; PTH, hormona paratiroidea; PTHrp, péptido relacionado con la PTH; PGE, prostaglandina E).
Las hormonas sexuales tienen un rol fisiológico en el control de la resorción. In vivo, la administración de estrógenos o de andrógenos disminuye la resorción ósea y favorece un balance cálcico positivo, al menos en el corto plazo. Se ha postulado que los estrógenos hacen a los osteoclastos más refractarios a la acción de la hormona paratiroidea. Hay receptores de estrógenos en células óseas de estirpe osteoblástica.
Considerados los principales factores que regulan la dinámica de la remodelación, un hecho parece incontrastable: para que haya osteoporosis, la resorción ósea debe exceder a la formación. Esto puede darse en cualquiera de las siguientes situaciones:
a) la formación disminuye mientras la resorción sigue su ritmo habitual;
b) la formación continúa normalmente, pero la resorción está acelerada.
Distintas técnicas han aportado argumentos para las dos hipótesis, pero lo más probable es que una pérdida anual de masa esquelética superior al 1 %, capaz de producir manifestaciones clínicas, se deba a una combinación de mecanismos:
e) la formación ósea disminuye y la resorción aumenta.
En la tabla 78-2 se da una clasificación de las distintas osteoporosis según su causa. Si se identifica un proceso patológico al que se le puede atribuir la osteopenia (p. ej., un hiperparatiroidismo, o un hipercortisolismo), ésta es considerada como “secundaria”. Si no, se concluye que se trata de una osteoporosis “primaria” o “idiopática”, de la cual se reconocen un tipo juvenil, muy raro, que afecta sobre todo a varones de 20 a 40 años, y la forma más común, la osteoporosis de la involución o senil, que por afectar predominantemente a mujeres después de los 50 años, recibe también al adjetivo de “posmenopáusica”.
Tabla 78-2
La fisiopatología de esta última es la mejor estudiada, y se resume en la figura 79-2.
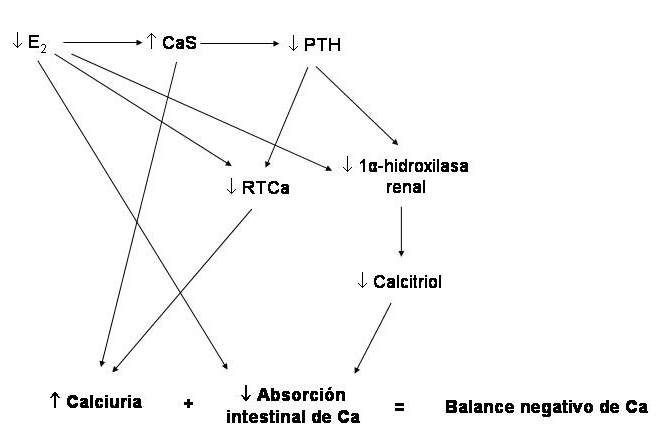
Figura 78-2: Fisiopatología de la osteoporosis postmenopáusica. (Abreviaturas: E2, estradiol; PTH, hormona paratiroidea; RTCa, reabsorción tubular de calcio).
Al disminuir el tenor de estrógenos por cesación de la función ovárica (castración, menopausia), hay desrepresión de la síntesis de numerosas citoquinas de origen linfo y monocítico (las principales son la interleuquinas 1 y 6, y el factor de necrosis tumoral alfa), que activan a los osteoclastos y ocasionan, por tanto, mayor actividad resortiva, con un leve aumento de la calcemia, que frena la secreción de PTH. Las consecuencias son un aumento de la resorción tubular de fósforo y una disminución de la de calcio. Se produce un aumento del fósforo sérico y del calcio urinario; la hipercalciuria se acentúa por falta de la estimulación de la reabsorción tubular de calcio que normalmente ejercen los estrógenos. Tanto la disminución de la PTH circulante como el aumento de la fosfatemia inhiben la actividad de la 1-alfa-hidroxilasa renal, con menor producción de calcitriol y, por consiguiente, menor absorción intestinal de calcio. Además, ésta disminuye por falta del estímulo directo de los estrógenos. El balance cálcico tiende a ser negativo. Con pequeños balances negativos no ocurre nada en el corto plazo, pero si la situación se prolonga meses y años, el depósito de donde se ha ido extrayendo el calcio –el hueso– acusará el impacto de la pérdida acumulativa (ejemplo: -20 mg/día por 3 años = -2,2 kg de calcio). Otro aspecto importante del espectro fisiopatológico de esta enfermedad es la apoptosis (muerte celular programada) que sufren los osteoblastos y los osteocitos debido a la carencia de estrógenos y al aumento de las citoquinas mencionadas más arriba. Con esto, disminuye la formación ósea, y es menos eficiente el proceso de reparación de microdaños en el tejido óseo.
La fisiopatología de la osteoporosis senil es algo diferente: en los viejos prima la menor generación de vitamina D en la piel por el efecto de los rayos ultravioletas de la luz solar, la síntesis disminuida de calcitriol por parte del riñón, y la menor eficacia de absorción intestinal de calcio, con menor capacidad de adaptación a dietas restringidas en calcio. Esto lleva a un hiperparatiroidismo secundario, que acelera el recambio óseo. Probablemente, también juega un rol el déficit relativo de hormona de crecimiento que se da en viejos, y la menor generación sistémica y local del factor de crecimiento insulino-símil 1 (IGF-1).
|
Tabla 78-3. Causas de osteoporosis
|
Síntomas y signos
En el síndrome osteopénico los síntomas son generalmente vagos y poco específicos, y no hay signos “patognomónicos”.
Generalmente el paciente se queja de dolores óseos o articulares difusos, mal definidos, los que con más frecuencia se ubican en la columna vertebral. Cuando ocurre una fractura (aplastamiento) vertebral –con o sin un esfuerzo o un traumatismo desencadenantes–, el dolor es intenso y localizado, pudiendo irradiarse a la parte anterior del tórax o del abdomen, según la altura de la vértebra afectada. Puede haber lumbalgia crónica de leve o moderada intensidad.
En sujetos que han sufrido el colapso de más de una vértebra, se produce una disminución de la talla, que resulta inferior a la envergadura (distancia que separa los extremos de los dedos mayores de ambas manos, con los brazos extendidos en cruz). Hay una disminución de la distancia vértex-pubis con respecto a la pubis-planta, que normalmente son iguales. El punto inferior del reborde costal se aproxima al ala ilíaca y puede llegar a tocarla; además, los brazos en posición de reposo parecen más largos, con las manos más próximas a las rodillas (fig. 78-3).
Cuando se aplastan dos o más vértebras dorsales consecutivas, la angulación de la columna lleva a una exageración de la cifosis dorsal fisiológica, con la aparición de una giba. Además, se produce una deformidad de toda la caja torácica, y una exageración compensatoria de la lordosis cervical.
Si bien las fracturas vertebrales, al igual que las de cuello femoral, se ven con más frecuencia en pacientes añosos, en mujeres y durante los primeros años después de la menopausia es más común ver fracturas de muñeca (tercio distal de radio y cúbito).
Salvo en el caso de fracturas recientes, no hay dolor a la presión de los huesos por parte del observador. Por lo demás, los pacientes con osteoporosis primaria gozan de buen estado general. En cambio, los que sufren una osteoporosis secundaria suelen presentar los síntomas y signos de las enfermedades asociadas.
F) En mujeres premenopáusicas con osteoporosis se cree que 1 de cada 2 tiene una forma secundaria de esta enfermedad, siendo las causas más comunes el hipoestrogenismo, los corticoides, el exceso de hormona tiroidea (endógena o exógena) y la terapia anticonvulsiva. En mujeres postmenopáusicas, la prevalencia de causas secundarias es seguramente mucho menor, pero la proporción real no se conoce. La hipercalciuria, el hiperparatiroidismo y la malabsorción son causas a tener en cuenta y fáciles de confirmar o descartar (solicitando calcemia, calciuria de 24 horas, estudio de digestibilidad de materia fecal, anticuerpos antigliadina y antiendomisio, p. ej.). Es decir que los estudios complementarios en mujeres postmenopáusicas con osteoporosis pueden ser necesarios en casos individuales, aunque no hay una estrategia clara ni una amplia evaluación de costo/beneficio.
G)
Metodología de estudio
H) Una buena historia clínica y un examen físico completo son esenciales en la evaluación del riesgo de fractura, y debe incluirse la medición de la talla: pérdidas de altura > 3 cm son indicio de aplastamientos vertebrales, al igual que la cifosis dorsal.
La radiología permite una apreciación, si bien grosera, de la magnitud del proceso, que causa un aumento de la trasparencia de los huesos. Para cuantificarla con mayor exactitud se usan diferentes métodos. Uno, que evalúa el hueso esponjoso, requiere radiografías de ambas cabezas femorales, para comparar el grado de “destrabeculación” con un patrón (índice de Singh; fig. 78-4). Otro, útil para evaluar el hueso compacto, establece la relación córtico-medular en huesos largos; generalmente se utiliza el segundo metacarpiano de la mano no dominante (radiogrametría de Garn). Normalmente, la suma del grosor de ambas cortezas debe ser superior o igual al diámetro de la cavidad medular; a medida que se pierde hueso compacto, se adelgaza la corteza diafisaria y aumenta el diámetro de la cavidad medular.
Las vértebras dorsales, al ceder su estructura frente a fuerzas compresivas, adoptan –al ser vistas de perfil– una forma de cuña; las lumbares, por protrusión generalizada de los discos intervertebrales, toman una forma bicóncava, como vértebras de pescado (figs. 72-5 y 72-6).
Otros métodos mucho más exactos, precisos y no invasivos permiten estimar el contenido mineral óseo: la densitometría radiológica y la tomografía axial computada cuantitativa miden la atenuación de un haz simple o doble de fotones que atraviesa el cuerpo. Esto permite determinar el contenido cálcico de la columna lumbar, de la extremidad proximal del fémur o de otras regiones (fig. 78-7).
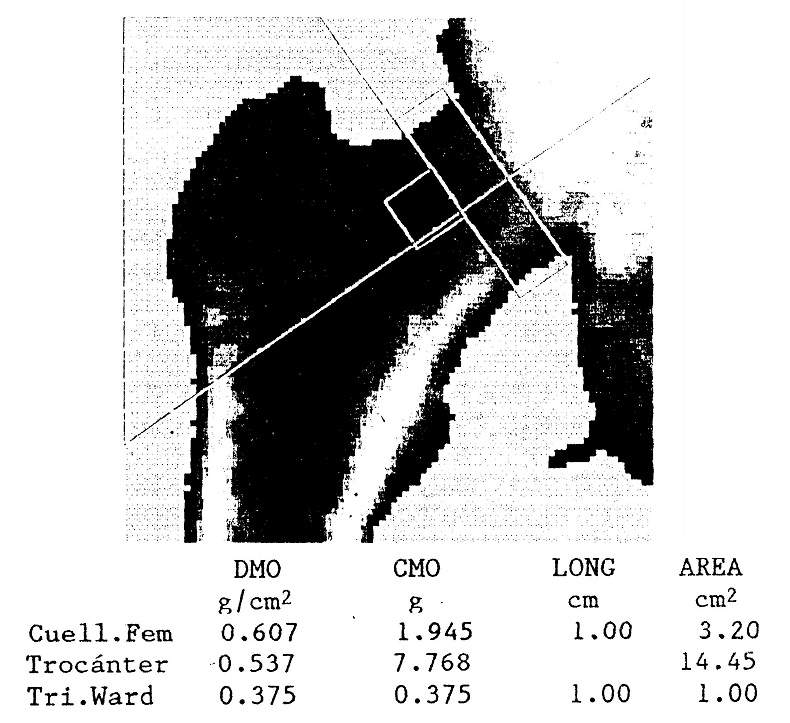
Figura 78-7: Imagen densitométrica de la extremidad proximal de un fémur derecho, estudiada por absorciometría dual de rayos X. Se informa el contenido mineral óseo (CMO, en gramos), el área (en cm2) y la densidad mineral ósea (DMO, en g/cm2) del cuello femoral, el trocánter mayor, y el triángulo de Ward.
También se utiliza el ultrasonido para evaluar la calidad del hueso periférico (el sitio generalmente estudiado es el calcáneo). La densitometría se correlaciona fuertemente con la resistencia a la fractura de la cadera y de las vértebras en ensayos biomecánicos, y también predice acertadamente el riesgo de fractura. Pueden evaluarse diferentes sitios del esqueleto y el contenido mineral total del mismo, aunque la densitometría de cuerpo entero se reserva para casos especiales e investigaciones clínicas.
I) Para el diagnóstico se utiliza el criterio de un comité de expertos de la OMS, que usa el valor T (definido como el número de DE por encima o por debajo de la media correspondiente a mujeres jóvenes sanas). El valor T debe distinguirse del Z, que se define como el número de DE por encima o por debajo de la media correspondiente a sujetos de la misma edad y el mismo sexo. De acuerdo a la definición de la OMS, la osteoporosis está presente cuando el valor T es inferior a -2,5 DE, o más negativo aún. Si el valor es positivo o superior a -1, la masa ósea se considera normal, y si está entre -1 y -2,49 se dice que hay “osteopenia”. Si el valor corresponde a osteopenia, pero existen ya fracturas por fragilidad, se hace el diagnóstico de osteoporosis. Aunque este criterio se basó originalmente en mediciones hechas en cadera con absorciometría dual de rayos X (DEXA), se ha extendido para evaluar otros sitios esqueléticos, y usando otras tecnologías. Existen dudas entre los expertos sobre si esta generalización brinda la misma información diagnóstica y predictiva. La medición en la cadera es mejor para predecir riesgo de fractura de cadera que la medición en otros sitios, igual que la medición en columna lumbar es mejor para predecir el riesgo de aplastamiento vertebral.
J) Desde el punto de vista del diagnóstico y de la evaluación de muchos sujetos, es aceptable el uso de aparatos más sencillos, a veces portátiles, que proveen información rápida y a menor costo, como DEXA de antebrazo distal o de calcáneo, o ultrasonido de falanges o de calcáneo. Sin embargo, los expertos coinciden en que una “osteoporosis” diagnosticada en un sitio periférico debe ser confirmada por una medición en un sitio axial, por DEXA o tomografía computada cuantitativa. Además, la densitometría periférica no está aceptada como válida para monitorear la respuesta ósea al tratamiento con drogas osteoactivas.
K) El laboratorio puede brindar además datos indicadores del recambio con los llamados “marcadores”: la fosfatasa alcalina total o su insoenzima de origen óseo y la osteocalcina séricas dan idea de la tasa de formación de nuevo hueso (actividad osteoblástica), mientras que la piridinolina y la desoxipiridinolina urinarias, y los péptidos del colágeno tipo I (CTX, NTX) medidos en suero u orina, dan idea de la tasa de resorción ósea (actividad osteoclástica). Estos marcadores no hacen el diagnóstico de osteoporosis, pero indican si el recambio es alto o normal y pueden orientar mejor al tipo de trastorno subyacente; por lo tanto, ayudan a elegir el tratamiento. Además, como varían de acuerdo a la variación del recambio, permiten evaluar la respuesta al tratamiento en períodos más cortos (semanas o meses) que los necesarios para medir los cambios en la masa ósea (mínimo 1 año). En sujetos añosos, y sobre todo en los institucionalizados que no hacen vida al aire libre ni se exponen al sol, es extremadamente útil la determinación del calcidiol (25-hidroxivitamina D) en suero y, si el valor es bajo, la de PTH sérica, ya que el hiperparatiroidismo secundario es causa común de osteoporosis senil y su prevalencia es alta en los viejos.
En síntesis, ante un enfermo con el síndrome osteoporótico, los esfuerzos del médico han de dirigirse a descartar las causas corregibles (desnutrición, hipertiroidismo, hiperparatiroidismo, etc.).
En todo paciente de más de 50 años que sufre una fractura, corresponde evaluar con métodos objetivos la masa ósea, para luego tomar medidas preventivas o curativas. También conviene medir la densidad ósea en personas que reúnan dos o más de los factores de riesgo enumerados en la tabla 2.
|
Tabla 2. Factores de riesgo de osteoporosis
|