Dr. Julio Libman, Dra Astrid Libman
Se define el hipopituitarismo como el cuadro resultante de la incapacidad de la hipófisis anterior para mantener una secreción hormonal adecuada a las necesidades del organismo.
Fisiopatología
El hipotálamo y la hipófisis anterior constituyen una unidad funcional de fundamental importancia que regula el crecimiento, la lactancia y las funciones tiroidea, adrenal y gonadal. Las alteraciones del hipotálamo pueden expresarse con frecuencia a través de diversas anomalías de la secreción de las hormonas de la hipófisis anterior. Ciertos núcleos hipotalámicos producen neurosecreciones, las hormonas hipotalámicas, que a través del sistema portal hipotálamo-hipofisario llegan a la hipófisis, donde ejercen una acción estimulante o inhibidora de la secreción de sus hormonas. Estas neuronas hipotalámicas peptidérgicas se encuentran a su vez bajo la influencia de neurotrasmisores (catecolaminas, serotonina) provenientes de centros superiores (fig. 59-1).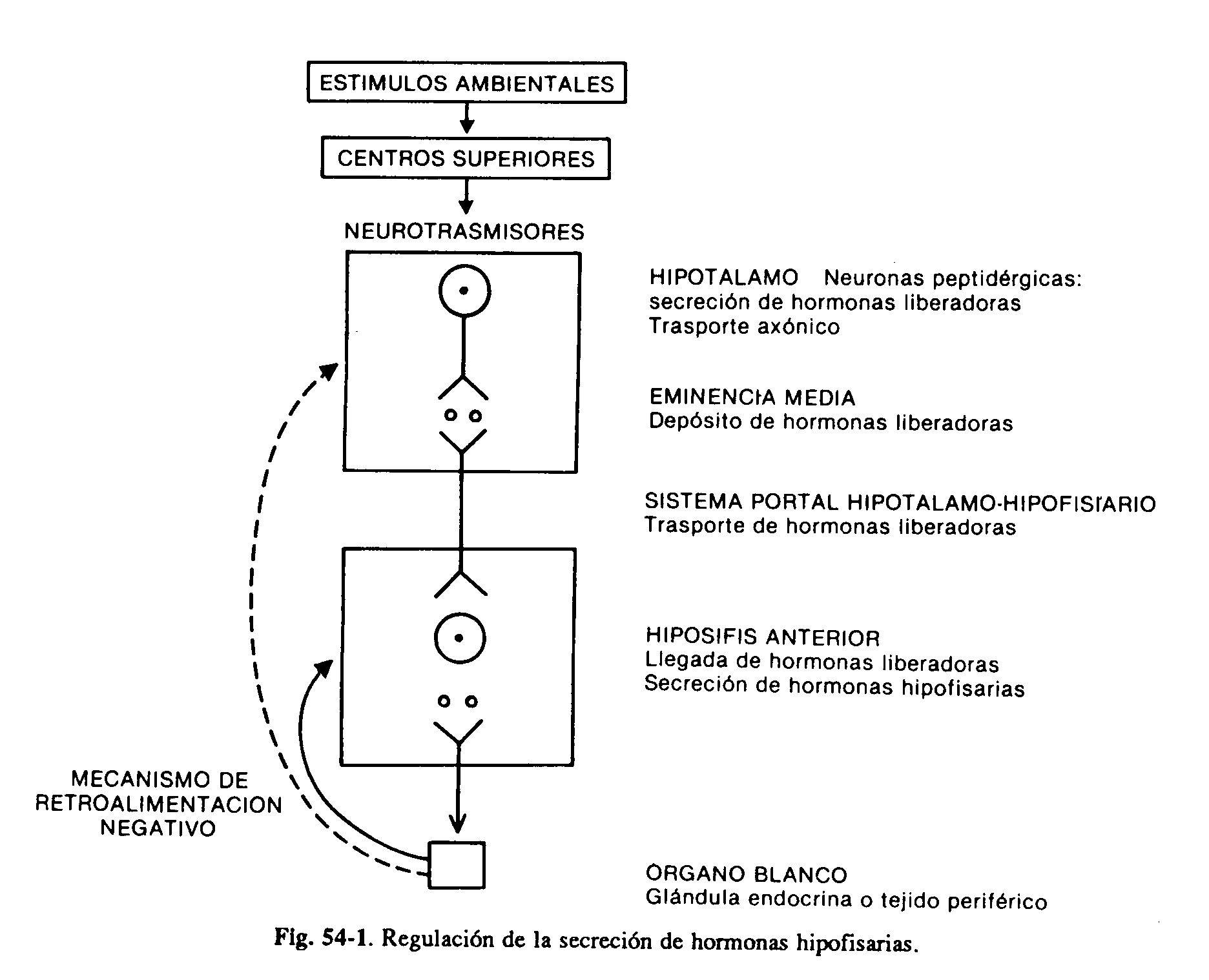
La hipófisis anterior produce seis hormonas de importancia clínica: las hormonas luteinizante (LH) y foliculoestimulante (FSH), tirotrofina (TSH), prolactina (PRL), somatotrofina u hormona de crecimiento (GH) y adrenocorticotrofina (ACTH). Las tres primeras son glucoproteínas compuestas por dos partes, las subunidades alfa y las betas; la sub-unidad alfa es similar en todas ellas, mientras que la beta le confiere a cada una su especificidad de acción. La GH y la PRL son péptidos constituidos por una sola cadena de aminoácidos con uniones disulfuro intramoleculares. La ACTH es un péptido de 39 aminoácidos, que deriva de una prohormona glucoproteica de mayor peso molecular, que da origen también a las lipotrofinas, endorfinas y hormona melanocitoestimulante (proopiomelanocortina).
Se han aislado cuatro hormonas hipotalámicas, péptidos de peso molecular bajo, que estimulan la secreción de varias hormonas hipofisarias. Son las hormonas liberadoras de TSH (TRH), de gonadotrofinas (GnRH), de hormona de crecimiento (GHRH) y de ACTH. La TRH estimula igualmente la secreción de prolactina, aun cuando no es claro su papel en circunstancias fisiológicas. Por otra parte, se han identificado dos sustancias inhibidoras: la somatostatina, que inhibe la secreción de GH y TSH, y la dopamina, que inhibe la secreción de PRL. Se deduce que la producción de por lo menos dos hormonas, la GH y la PRL, se encuentra bajo el control de un doble mecanismo estimulante e inhibidor (fig. 59-2). Si bien la principal influencia del hipotálamo sobre la secreción de las hormonas hipofisarias es de tipo estimulante, la PRL es la única que se encuentra sometida a un tono predominantemente inhibidor. La interrupción del tallo hipotálamo-hipofisario determina por consiguiente la disminución de la producción de todas las hormonas adenohipofisarias, con excepción de la prolactina, que se incrementa. La producción de las hormonas de la adenohipófisis se encuentra regulada a su vez por las secreciones de las glándulas periféricas. Las hormonas tiroideas, especialmente la T3 derivada de las desyodinación intrahipofisaria de la T4, inhiben la respuesta del tirotropo a la TRH. El cortisol actúa igualmente a nivel hipofisario para inhibir la producción de ACTH.
Los esteroides gonadales ejercen en la mujer un efecto de retroalimentación positiva o negativa sobre la respuesta hipofisaria a la GnRH, que depende de las concentraciones plasmáticas de los estrógenos. En mujeres hipogonadales, castradas o posmenopáusicas ejercen una retroalimentación negativa. Por el contrario, en mujeres eugonadales la repuesta de LH y FSH a la GnRH está incrementada por los niveles altos de estrógenos. En el varón, la testosterona suprime la síntesis de LH, mientras que la testosterona y la inhibina producida por las células de Sertoli suprimen la FSH.
Numerosos factores, como el estrés, el sueño, el aumento de los aminoácidos circulantes y la disminución de la glucemia y los ácidos grasos libres estimulan la secreción de GH actuando a través del hipotálamo.
La secreción de PRL es estimulada en condiciones normales por el estrés, el ejercicio, la hipoglucemia, el hiperestrogenismo y la estimulación del pezón y la mama, mecanismo éste que requiere la integridad de la vía neural aferente de la mama al SNC.
Cada una de las trofinas hipofisarias desempeña un papel fundamental en el mantenimiento de la integridad anatómica y funcional de la glándula periférica correspondiente. La TSH estimula los diferentes pasos metabó1icos que conducen a la síntesis y liberación de T4 y T3. La ACTH mantiene la estructura y funcionalismo de las zonas reticular y fascicular de las suprarrenales.
|
Tabla 59-1: Etiología del Hipopituitarismo
|
Las gonadotrofinas estimulan la gametogénesis y la síntesis de los esteroides sexuales. El déficit de cada una de ellas se traduce en un cuadro de hipofunción del órgano blanco respectivo. La única función claramente establecida para la PRL en humanos se relaciona con la lactancia, y su ausencia se traduce en una falta de secreción láctea (agalactia). La GH ejerce una serie de acciones metabólicas (anabolismo proteico, lipólisis, aumento de la resistencia periférica a la insulina con tendencia a la elevación de la glucemia) y estimula el crecimiento y la multiplicación celular. Estas acciones, excepto su efecto sobre el metabolismo lipídico e hidrocarbonado, son mediadas por péptidos producidos en el hígado y otros tejidos, que reciben el nombre de somatomedinas. Las somatomedinas o factores de crecimiento insulino símiles (IGF-I y II) son elaborados bajo el control de la GH y poseen una acción promotora del crecimiento sobre una amplia variedad de tejidos, principalmente cartílago y hueso. Ejercen además un efecto inhibidor de la secreción de GH a través de un mecanismo de retroalimentación negativa sobre el hipotálamo y la hipófisis. Su ausencia determina fundamentalmente una marcada disminución en la velocidad de crecimiento.
Una amplia gama de procesos patológicos pueden ser causa de insuficiencia hipofisaria, y las etiologías más frecuentes son la tumoral (adenomas), vascular e idiopática. Tumores hipofisarios, como los adenomas cromófobos o paraselares, como los craneofaringiomas, más comunes en la infancia, pueden producir hipopituitarismo. En general, y por razones poco claras, la capacidad secretoria de la GH y las gonadotrofinas es la primera en afectarse en presencia de adenomas hipofisarios (60 a 80%), mientras que las manifestaciones clínicas de deficiencia de TSH y ACTH se observan en sólo el 15 al 30 %. De hecho, puede existir una marcada disminución de la masa hipofisaria con preservación de una función normal.
Los adenomas hipofisarios funcionantes pueden influir en la producción hormonal de la hipófisis extratumoral por mecanismos distintos de la compresión o la destrucción directa. Es conocida la inhibición de la secreción de gonadotrofinas por el efecto de la hiperprolactinemia, y la supresión en grados variables de las gonadotrofinas, GH, PRL y TSH por un exceso de cortisol.
Si bien los tumores de mama y broncogénicos son los que más comúnmente dan metástasis en la hipófisis, es excepcional que produzcan una deficiencia funcional anterohipofisaria. Aun cuando diversos procesos infiltrativos pueden afectar en forma directa a la glándula, afecciones tales como la histiocitosis X y la sarcoidosis producen alteraciones hipotalámicas que causan un déficit hipofisario secundario a las mismas.
La irradiación externa puede ser causa de un hipopituitarismo, habitualmente parcial, susceptible de presentarse hasta diez años después de recibir la radiación ionizante, y atribuible a una acción directa sobre las células o a una vasculitis del sistema portal hipotálamo-hipofisario. La hemocromatosis y la hemosiderosis pueden afectar la hipófisis en forma directa.
Una de las causas propias del sexo femenino es la necrosis isquémica posparto (síndrome de Sheehan). Se presenta en mujeres que padecieron hemorragia, sepsis y shock a continuación del parto, lo cual produce isquemia y necrosis, atribuible a la circunstancia de que la glándula, habiendo aumentado de tamaño durante el embarazo por hiperplasia de los lactotropos, y careciendo de un aporte sanguíneo directo, es particularmente sensible a la disminución del flujo vascular que se produce en esas circunstancias.
Existen deficiencias aisladas de algunas hormonas, determinadas por una falta congénita de las correspondientes hormonas liberadoras. Las más frecuentes son la deficiencia aislada de GH, causa de un marcado déficit estatural, y la de gonadotrofinas, que produce un hipogonadismo hipogonadotrófico que, asociado a anosmia o hiposmia por hipoplasia del bulbo olfatorio, determina el síndrome de Kallmann. La tabla 59-1 resume las etiologías del hipopituitarismo.
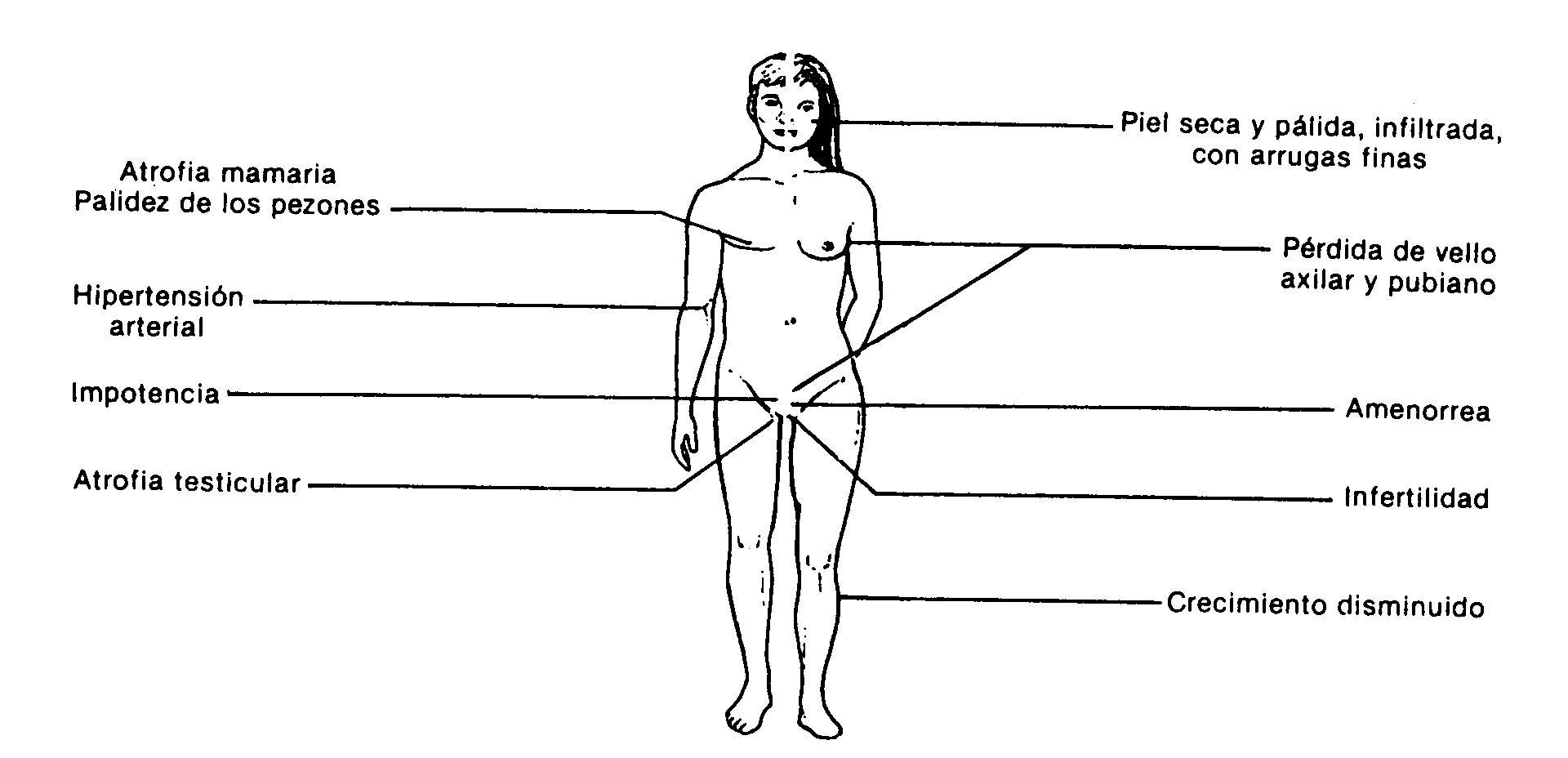 Fig.: 59-3: Manifestaciones clínicas del hipopituitarismo
Fig.: 59-3: Manifestaciones clínicas del hipopituitarismo
Síntomas y signos
Las manifestaciones clínicas dependen de las hormonas afectadas. En los adultos la sintomatología más frecuente corresponde al hipogonadismo secundario al déficit de gonadotrofinas. El retraso de crecimiento por falta de somatotrofina es el motivo de consulta más común en niños. Los adultos con panhipopituitarismo tienen una apariencia característica (fig. 59-3): ausencia de vello pubiano y axilar, atrofia de mamas y genitales, palidez de la piel y aréolas, piel con arrugas finas y pobre desarrollo muscular. Los pacientes del sexo masculino no presentan la característica recesión temporal en la implantación del cabello. Pueden tener un aspecto infiltrado por hipotiroidismo secundario.
Deficiencia de somatotrofina (GH). Causa retraso en el crecimiento y la edad ósea con conservación de las proporciones corporales. Existe mayor cantidad de tejido adiposo en el tronco, por falta de la acción lipolítica de la GH. La voz tiende a ser aguda por un menor desarrollo laríngeo. La aparición de hipoglucemias es más común en los recién nacidos con deficiencia congénita de GH. En los adultos con hiposomatotrofismo son comunes la astenia, depresión y el aumento de peso.
Deficiencia de gonadotrofinas. El hipogonadismo es la manifestación endocrina más común en la deficiencia hipofisaria del adulto. La carencia de gonadotrofinas que aparece antes de la edad puberal se caracteriza por 1a falta de desarrollo de los caracteres sexuales primarios y secundarios, con la infertilidad consiguiente. Los varones no desarrollan la barba, la recesión temporal en la implantación del cabello, el cambio en las características de la voz ni el aumento del tamaño testicular y del pene, así como de las glándulas sexuales accesorias (próstata y vesículas seminales). Las niñas presentan amenorrea primaria y falta de desarrollo mamario. Ambos sexos pueden tener vello pubiano y axilar escaso o ausente, aun cuando en el sexo femenino su presencia depende principalmente de los andrógenos adrenales. Si la producción de GH es adecuada los pacientes pueden continuar su crecimiento y adquirir aspecto eunucoide debido a la persistencia de los cartílagos diafisoepifisarios de los huesos largos por carencia de esteroides sexuales.
En la mujer en edad reproductiva el hipogonadotrofismo se manifiesta por oligohipomenorrea o amenorrea secundaria, existiendo atrofia uterina y mamaria y disminución de la cornificación de las células vaginales por ausencia de estrógenos. En el varón adulto la atrofia testicular se acompaña de disminución de la libido, la potencia, el tono muscular y el crecimiento de la barba y el vello.
Deficiencia de TSH. El cuadro de hipotiroidismo secundario a la carencia de TSH es similar al primario, pero con frecuencia menos severo. Son comunes la somnolencia y la astenia. La piel, además de infiltrada y pálida presenta, principalmente en la cara, finas arrugas atribuibles al déficit gonadal concomitante
Deficiencia de ACTH. Contribuye a la palidez de la piel y los pezones, así como la astenia. Raramente se presenta como una insuficiencia suprarrenal aguda, excepto en situaciones de estrés. Esto se debe en parte a la conservación de la secreción de aldosterona por la zona glomerular de la corteza adrenal, que depende mínimamente de la ACTH
Deficiencia de prolactina. Se manifiesta por la agalactia posterior al parto. En este sentido es también característica la historia de las pacientes con el síndrome de Sheehan que, a continuación de un parto con hemorragia y shock, presentan agalactia, amenorrea, atrofia genital y mamaria, caída del vello pubiano y axilar, palidez, aspecto infiltrado y astenia En caso de existir un adenoma de hipófisis pueden predominar los síntomas y signos de masa tumoral sobre las manifestaciones endocrinas generales.
Metodología de estudio
Comprende la evaluación neurorradiológica y la endocrina.
Evaluación neurorradiológica. Intenta definir la presencia o ausencia de una masa tumoral, su prolongación más allá de los límites de la silla turca y el compromiso del quiasma óptico y demás estructuras vecinas. Se detalla en el capítulo 53 (síndrome tumoral hipofisario).
Evaluación endocrina. Tiene por objeto determinar la reserva funcional de la glándula.
Somatotrofina. Las concentraciones normales se encuentran en general por debajo de 10 ng/ml, medidas por radioinmunoanálisis. Considerando que una persona normal puede tener en un momento dado valores que se superponen con los de un paciente hipopituitario, es fundamental recurrir a una prueba de estímulo para evaluar la respuesta somatotrófica, produciéndose incrementos sustanciales en los individuos sanos, mientras que en los hipopituitarios no se producen o son mínimos.
Prueba de hipoglucemia insulínica. Constituye una de las mejores y es de elección en el estudio de pacientes con baja estatura en quienes se sospecha un hiposomatotrofismo. Se basa en la relación inversa existente entre glucemia y niveles de somatotrofina. Un descenso de la glucosa disponible a nivel de los núcleos hipotalámicos reguladores de la secreción de GH determina su liberación, lo cual resulta en un aumento del sustrato energético circulante, a través de la acción lipolítica de la hormona y del aumento de la resistencia periférica a la acción de la insulina. Se obtienen muestras de plasma venoso para glucemia y somatotrofina antes y a los 30, 60 y 90 minutos de la administración E.V. en bolo de 0,1 U de insulina corriente por kilogramo de peso. En circunstancias normales, y cuando la glucemia desciende por los menos a la mitad de los valores basales, se produce un incremento en la somatotrofina que duplica, como mínimo, las cifras iniciales.
Prueba de L-DOPA. Se cuantifica la GH antes y a los 60 y 90 minutos de la administración de 500 mg de L-DOPA. En los niños se dan cantidades proporcionalmente menores. Normalmente se observa un aumento que excede el 100% o sobrepasa los 10 ng/ml. El 25% de los individuos sanos tiene respuestas negativas.
LH y FSH. Una sola determinación de LH y FSH permite diferenciar un hipogonadismo primario, por lesión de la gónada, de uno secundario, por alteración hipotálamohipofisaria. La existencia de niveles de testosterona o estradiol bajos con LH y FSH altos apunta al primer diagnóstico; por el contrario, la falta de elevación de las gonadotrofinas en circunstancias similares, orienta a la segunda posibilidad. Las concentraciones basales de LH y FSH en los varones normales y en mujeres en edad reproductiva durante las fases folicular y luteínica del ciclo están por debajo de 15 mUI/ml. Durante el pico ovulatorio y después de la menopausia, las cifras se incrementan de 2 a 4 veces.
Prueba de GnRH. Se utiliza para evaluar la reserva hipofisaria de gonadotrofinas. Se obtienen muestras de plasma antes y a los 30 y 60 minutos de la inyección E.V. en bolo de 50 ugs. de la hormona hipotalámica liberadora de gonadotrofinas. Normalmente se produce un pico a los 30 minutos, con un incremento de por lo menos un 100% para la LH y algo menor para la FSH.
TSH. Al igual que con las gonadotrofinas, una sola determinación de TSH permite distinguir un hipotiroidismo primario por lesión de la glándula tiroides, de uno secundario, por alteración hipofisaria. Una T4 y T3 bajas con THS elevada, confirma el primer diagnóstico, mientras que la falta de aumento de la TSH en las mismas condiciones indica lesión hipofisaria. Las concentraciones normales de TSH varían entre 0,5 y 4,5 uU/ml.
Prueba de la TRH. Se cuantifica la TSH antes y a los 20 minutos de la administración EV de 200 ugs. de la hormona hipotalámica liberadora de TSH, lo cual permite determinar la reserva hipofisaria de la misma. El incremento mínimo es de 8 uU/ml, alcanzando valores entre 12 y 25 uU/ml.
Dosaje de prolactina. La determinación de prolactina es fundamental en la evaluación endocrina de un hipopituitarismo, dado que su aumento es común en los adenomas hipofisarios (60-65%) y en alteraciones hipotalámicas debidas a interferencia con la inhibición tónica de su secreci6n. Normalmente las concentraciones son menores de 25 ng/ml en mujeres y de 20 ng/ml en varones, en muestras obtenidas entre las 8 y 10 horas.
Dosaje de ACTH. La ACTH plasmática presenta normalmente un ritmo circadiano, con cifras de 50 a 80 picogramos/ml en horas de la mañana y de 10 a 30 picogramos/ml en horas de la tarde. La hipoglucemia insulínica es probablemente la prueba más sensible para evaluar el eje hipotálamo-hipófiso-adrenal. Su utilidad aumenta ya que se puede establecer simultáneamente la reserva de GH y prolactina. Se determina como parámetro de evaluación el cortisol plasmático antes y a los 30 y 60 minutos de la administración EV de la insulina corriente. En condiciones normales hay un incremento de por lo menos 7 ng/dl, debiendo pasar los 18 ng/dl.