Julio Libman, Astrid L. Libman
O hipopituitarismo é definido como a condição resultante da incapacidade da hipófise anterior de manter a secreção hormonal adequada às necessidades do corpo.
Fisiopatologia
O hipotálamo e a pituitária anterior são uma unidade funcional crítica que regula o crescimento, a lactação e as funções tireoidiana, adrenal e gonadal. Os distúrbios do hipotálamo podem frequentemente ser expressos por meio de várias anormalidades na secreção de hormônios da pituitária anterior. Certos núcleos hipotalâmicos produzem neurossecreções, os hormônios hipotalâmicos, que através do sistema portal hipotálamo-hipofisário chegam à hipófise, onde exercem ação estimulante ou inibidora da secreção de seus hormônios. Esses neurônios hipotalâmicos peptidérgicos estão, por sua vez, sob a influência de neurotransmissores (catecolaminas, serotonina) de centros superiores (Fig. 59-1).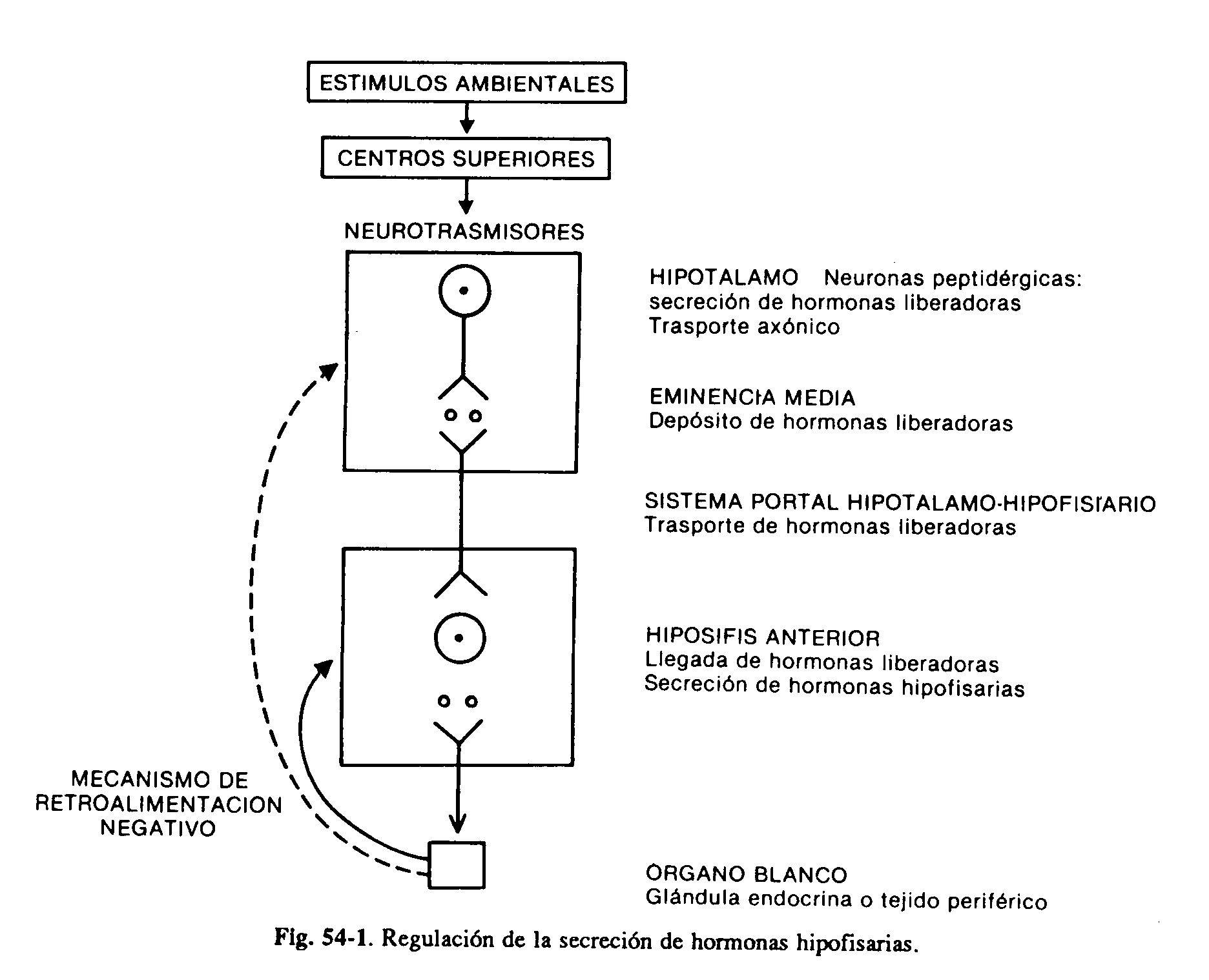
A hipófise anterior produz seis hormônios clinicamente importantes: hormônios luteinizantes (LH) e estimuladores do folículo (FSH), tireotrofina (TSH), prolactina (PRL), somatotrofina ou hormônio do crescimento (GH) e adrenocorticotrofina (ACTH). Os três primeiros são glicoproteínas compostas por duas partes, as subunidades alfa e beta; a subunidade alfa é semelhante em todos eles, enquanto o beta dá a cada um sua especificidade de ação. GH e PRL são peptídeos constituídos por uma única cadeia de aminoácidos com ligações dissulfeto intramoleculares. O ACTH é um peptídeo de 39 aminoácidos, derivado de um pró-hormônio glicoproteico de maior peso molecular, que também dá origem a lipotropinas, endorfinas e hormônio estimulador da melanocito (proopiomelanocortina).
Quatro hormônios hipotalâmicos, peptídeos de baixo peso molecular, foram isolados e estimulam a secreção de vários hormônios hipofisários. Eles são os hormônios liberadores de TSH (TRH), gonadotrofinas (GnRH), hormônio do crescimento (GHRH) e ACTH. A TRH também estimula a secreção de prolactina, embora seu papel nas circunstâncias fisiológicas não seja claro. Por outro lado, duas substâncias inibidoras foram identificadas: a somatostatina, que inibe a secreção de GH e TSH, e a dopamina, que inibe a secreção de PRL. Conclui-se que a produção de pelo menos dois hormônios, GH e PRL, está sob o controle de um mecanismo duplo estimulador e inibitório (Fig. 59-2). Embora a principal influência do hipotálamo sobre a secreção de hormônios hipofisários seja estimulante,O PRL é o único sujeito a um tom predominantemente inibitório. A interrupção da haste hipotálamo-hipofisária determina, conseqüentemente, a diminuição da produção de todos os hormônios adeno-hipofisários, com exceção da prolactina, que está aumentada. A produção de hormônios na adeno-hipófise é, por sua vez, regulada por secreções das glândulas periféricas. Os hormônios tireoidianos, especialmente T3 derivados da desiodação intra-hipofisária de T4, inibem a resposta tireotrópica ao TRH. O cortisol também atua no nível pituitário para inibir a produção de ACTH. com exceção da prolactina, que está aumentada. A produção de hormônios na adeno-hipófise é, por sua vez, regulada por secreções das glândulas periféricas.Os hormônios tireoidianos, especialmente T3 derivados da desiodação intra-hipofisária de T4, inibem a resposta tireotrópica ao TRH. O cortisol também atua no nível pituitário para inibir a produção de ACTH. com exceção da prolactina, que está aumentada. A produção de hormônios na adeno-hipófise é, por sua vez, regulada por secreções das glândulas periféricas. Os hormônios tireoidianos, especialmente T3 derivados da desiodação intra-hipofisária de T4, inibem a resposta tireotrópica ao TRH. O cortisol também atua no nível pituitário para inibir a produção de ACTH.
Os esteróides gonadais exercem um efeito de feedback positivo ou negativo na resposta hipofisária ao GnRH em mulheres, que depende das concentrações plasmáticas de estrogênio. Em mulheres hipogonadais, castradas ou na pós-menopausa, eles exercem um feedback negativo. Em contraste, em mulheres eugonatais, a resposta de LH e FSH ao GnRH é aumentada por altos níveis de estrogênios. No homem, a testosterona suprime a síntese de LH, enquanto a testosterona e a inibina produzida pelas células de Sertoli suprimem o FSH.
Vários fatores, como estresse, sono, aumento dos aminoácidos circulantes e diminuição da glicose no sangue e dos ácidos graxos livres estimulam a secreção de GH, agindo através do hipotálamo.
A secreção de PRL é estimulada em condições normais por estresse, exercícios, hipoglicemia, hiperestrogenismo e estimulação do mamilo e da mama, um mecanismo que exige a integridade da via neural da mama ao SNC.
Cada um dos troféus hipofisários desempenha um papel fundamental na manutenção da integridade anatômica e funcional da glândula periférica correspondente. O TSH estimula as diferentes etapas metabólicas que levam à síntese e liberação de T4 e T3. O ACTH mantém a estrutura e o funcionalismo das áreas reticular e fascicular das supra-renais.
|
Tabela 59-1: Etiologia do hipopituitarismo
|
As gonadotrofinas estimulam a gametogênese e a síntese de esteróides sexuais. O déficit de cada um deles se traduz em um quadro de hipofunção do respectivo órgão-alvo. O único papel claramente estabelecido para PRL em humanos está relacionado à lactação, e sua ausência resulta em falta de secreção de leite (agalactia). O GH exerce uma série de ações metabólicas (anabolismo de proteínas, lipólise, aumento da resistência periférica à insulina com tendência a aumentar a glicose no sangue) e estimula o crescimento e a multiplicação celular. Essas ações, exceto seu efeito no metabolismo de lipídios e hidrocarbonetos, são mediadas por peptídeos produzidos no fígado e outros tecidos, que são chamados de somatomedinas.Somatomedinas ou fatores de crescimento semelhantes à insulina (IGF-I e II) são produzidos sob o controle do GH e têm ação promotora de crescimento em uma ampla variedade de tecidos, principalmente cartilagem e osso. Eles também exercem um efeito inibitório sobre a secreção de GH por meio de um mecanismo de feedback negativo no hipotálamo e na hipófise. Sua ausência determina fundamentalmente uma diminuição acentuada na velocidade de crescimento.
Uma ampla gama de processos patológicos pode ser a causa da insuficiência hipofisária, e as etiologias mais frequentes são tumor (adenomas), vascular e idiopática. Tumores hipofisários, como adenomas cromofóbicos ou parasselares, como craniofaringiomas, mais comuns na infância, podem produzir hipopituitarismo. Em geral, e por razões obscuras, a capacidade secretora de GH e gonadotrofinas é a primeira a ser afetada na presença de adenomas hipofisários (60 a 80%), enquanto as manifestações clínicas de deficiência de TSH e ACTH são observadas em apenas 15 a 30 %. Na verdade, pode haver uma diminuição acentuada da massa hipofisária com preservação da função normal.
Os adenomas hipofisários em funcionamento podem influenciar a produção de hormônios da hipófise extratumoral por mecanismos diferentes da compressão ou destruição direta. É conhecida a inibição da secreção de gonadotrofinas devido ao efeito da hiperprolactinemia e a supressão em vários graus das gonadotrofinas, GH, PRL e TSH por um excesso de cortisol.
Embora os tumores de mama e broncogênicos sejam os que mais comumente metastatizam para a hipófise, é raro que eles produzam uma deficiência funcional antero-hipofisária. Embora vários processos infiltrativos possam afetar diretamente a glândula, condições como histiocitose X e sarcoidose produzem alterações hipotalâmicas que causam déficit hipofisário secundário.
A irradiação externa pode ser a causa do hipopituitarismo, geralmente parcial, com probabilidade de aparecer até dez anos após o recebimento da radiação ionizante e atribuível a uma ação direta nas células ou à vasculite do sistema portal hipotálamo-hipofisário. A hemocromatose e a hemossiderose podem afetar diretamente a hipófise.
Uma das causas do sexo feminino é a necrose isquêmica pós-parto (síndrome de Sheehan). Ocorre em mulheres que sofreram hemorragia, sepse e choque após o parto, o que produz isquemia e necrose, atribuível à circunstância de a glândula ter aumentado de tamanho durante a gravidez devido à hiperplasia lactotrópica e sem fluxo sanguíneo direto ser particularmente sensível à diminuição no fluxo vascular que ocorre nessas circunstâncias.
Existem deficiências isoladas de alguns hormônios, determinadas por uma falta congênita dos hormônios de liberação correspondentes. As mais frequentes são a deficiência isolada de GH, causa de déficit de estatura acentuado, e a deficiência de gonadotrofina, que produz hipogonadismo hipogonadotrófico que, associado à anosmia ou hiposmia por hipoplasia do bulbo olfatório, determina a síndrome de Kallmann. A Tabela 59-1 resume as etiologias do hipopituitarismo.
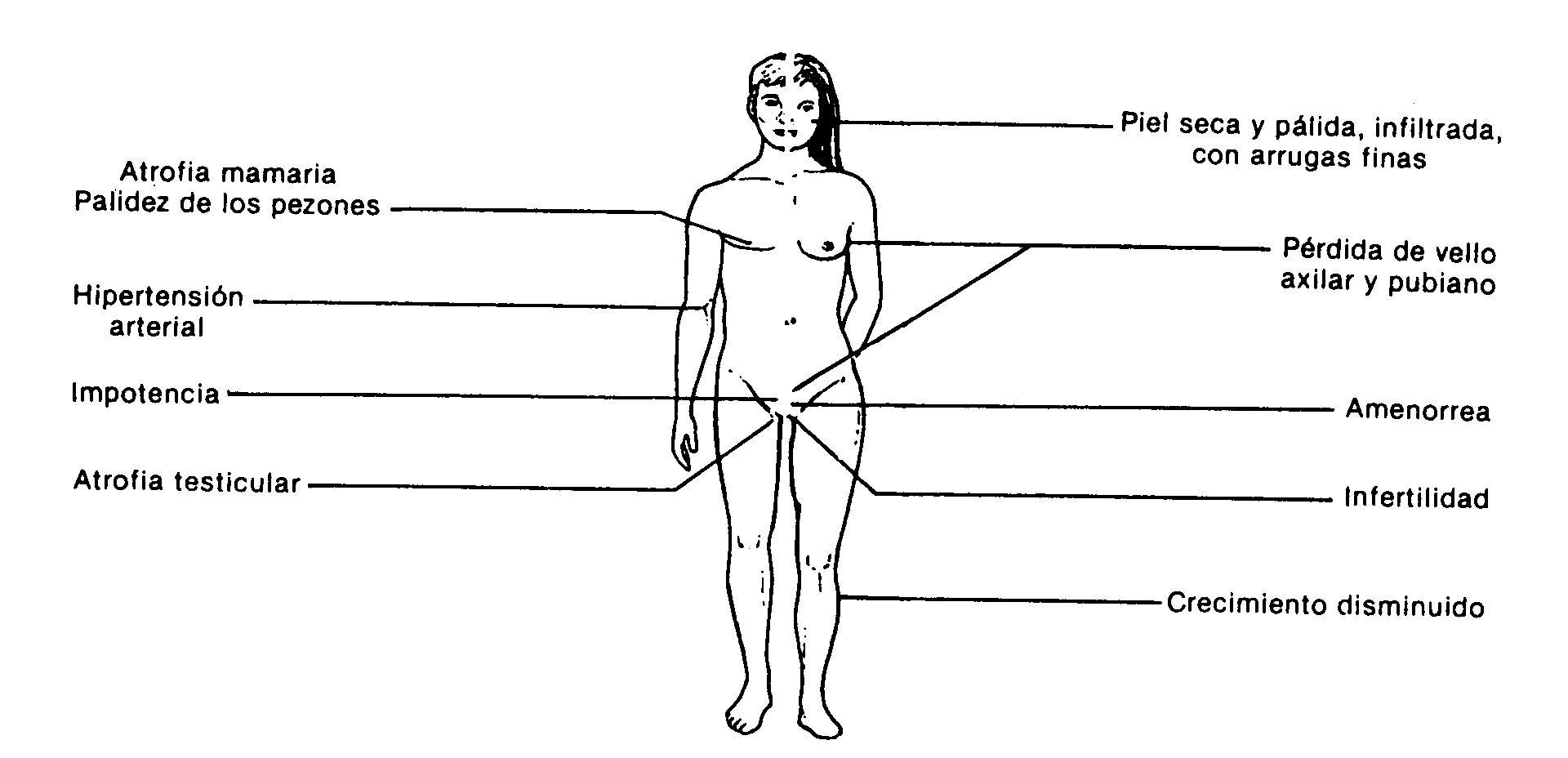 Fig.: 59-3: manifestações clínicas de hipopituitarismo
Fig.: 59-3: manifestações clínicas de hipopituitarismo
Sintomas e sinais
As manifestações clínicas dependem dos hormônios afetados. Em adultos, a sintomatologia mais frequente corresponde ao hipogonadismo secundário à deficiência de gonadotrofina. O retardo do crescimento devido à falta de somatotropina é o motivo mais comum de consulta em crianças. Adultos com pan-hipopituitarismo têm uma aparência característica (Fig. 59-3): ausência de pelos pubianos e axilares, atrofia das mamas e genitais, pele e aréolas pálidas, pele com linhas finas e desenvolvimento muscular deficiente. Pacientes do sexo masculino não apresentam a recessão temporária característica na implantação capilar. Eles podem ter uma aparência infiltrada devido ao hipotireoidismo secundário.
Deficiência de somatotrofina (GH) . Causa retardo no crescimento e idade óssea com preservação das proporções corporais. Há maior quantidade de tecido adiposo no tronco, devido à falta da ação lipolítica do GH. A voz tende a ser aguda devido ao menor desenvolvimento laríngeo. A hipoglicemia é mais comum em recém-nascidos com deficiência congênita de GH. Astenia, depressão e ganho de peso são comuns em adultos com hiposomatotrofismo.
Deficiência de gonadotrofina . O hipogonadismo é a manifestação endócrina mais comum na deficiência hipofisária do adulto. A deficiência de gonadotrofina que surge antes da puberdade é caracterizada pela falta de desenvolvimento das características sexuais primárias e secundárias, com consequente infertilidade. Os homens não desenvolvem barba, recessão temporária na implantação do cabelo, alteração das características vocais ou aumento do tamanho dos testículos e do pênis, bem como das glândulas sexuais acessórias (próstata e vesículas seminais). As meninas têm amenorréia primária e falta de desenvolvimento da mama. Ambos os sexos podem ter poucos ou ausentes pelos pubianos e axilares, embora no sexo feminino sua presença dependa principalmente dos andrógenos adrenais.
Nas mulheres em idade reprodutiva, o hipogonadotrofismo se manifesta por oligohipomenorréia ou amenorreia secundária, com atrofia uterina e mamária e diminuição da cornificação das células vaginais pela ausência de estrogênios. No homem adulto, a atrofia testicular é acompanhada por uma diminuição da libido, potência, tônus muscular e crescimento da barba e do cabelo.
Deficiência de TSH . O quadro de hipotireoidismo secundário à deficiência de TSH é semelhante ao primário, mas geralmente menos grave. Sonolência e astenia são comuns. A pele, além de infiltrada e pálida, apresenta, principalmente na face, rugas finas atribuíveis ao déficit gonadal concomitante
Deficiência de ACTH . Contribui para pele e mamilos pálidos, bem como para astenia. Raramente se apresenta como insuficiência adrenal aguda, exceto em situações estressantes. Isso se deve em parte à conservação da secreção de aldosterona pela zona glomerular do córtex adrenal, que é minimamente dependente do ACTH.
Deficiência de prolactina . É manifestada por agalactia pós-parto. Nesse sentido, também é característica a história de pacientes com síndrome de Sheehan que, após parto com hemorragia e choque, apresentam agalactia, amenorréia, atrofia genital e mamária, perda de pelos pubianos e axilares, palidez, aspecto infiltrado e Astenia. é um adenoma hipofisário, os sintomas e sinais de uma massa tumoral podem predominar sobre as manifestações endócrinas gerais.
Metodologia de estudo
Inclui avaliação neurorradiológica e endócrina.
Avaliação neurorradiológica . Tenta definir a presença ou ausência de massa tumoral, sua extensão além dos limites da sela túrcica e o envolvimento do quiasma óptico e outras estruturas vizinhas. É detalhado no Capítulo 53 (Síndrome do Tumor Pituitário).
Avaliação endócrina . Seu objetivo é determinar a reserva funcional da glândula.
Somatotrofina . As concentrações normais são geralmente abaixo de 10 ng / ml, conforme medido por radioimunoensaio. Considerando que uma pessoa normal pode em um dado momento ter valores que se sobrepõem aos de um paciente hipopituitário, é imprescindível recorrer a um teste de estímulo para avaliar a resposta somatotrófica, produzindo aumentos substanciais em indivíduos saudáveis, enquanto nos hipopituitários é não. ocorrem ou são mínimas.
Teste de hipoglicemia de insulina . É um dos melhores e de escolha no estudo de pacientes com baixa estatura nos quais há suspeita de hiposomatotrofismo. Baseia-se na relação inversa entre os níveis de glicose no sangue e os níveis de somatotrofina. A diminuição da glicose disponível ao nível dos núcleos hipotalâmicos que regula a secreção de GH determina sua liberação, o que resulta em aumento do substrato energético circulante, por meio da ação lipolítica do hormônio e aumento da resistência periférica à ação da insulina. Amostras de plasma venoso para glicose no sangue e somatotrofina são obtidas antes e 30, 60 e 90 minutos após a administração de bolus IV de 0,1 U de insulina padrão por quilograma de peso corporal.Em circunstâncias normais, e quando a glicose no sangue cai em pelo menos metade dos valores basais,
Teste L-DOPA . O GH é quantificado antes e 60 e 90 minutos após a administração de 500 mg de L-DOPA. Em crianças, quantidades proporcionalmente menores são dadas. Um aumento que excede 100% ou excede 10 ng / ml é geralmente observado. 25% dos indivíduos saudáveis têm respostas negativas.
LH e FSH . Uma única determinação de LH e FSH permite diferenciar um hipogonadismo primário, por dano à gônada, de um secundário, por alteração hipotalâmica da hipófise. A existência de níveis baixos de testosterona ou estradiol com LH e FSH elevados aponta para o primeiro diagnóstico; pelo contrário, a falta de elevação das gonadotrofinas em circunstâncias semelhantes leva à segunda possibilidade. As concentrações basais de LH e FSH em homens e mulheres normais em idade reprodutiva durante as fases folicular e lútea do ciclo estão abaixo de 15 mIU / ml. Durante o pico ovulatório e após a menopausa, os números aumentam de 2 a 4 vezes.
Teste GnRH . É usado para avaliar a reserva de gonadotrofina hipofisária. As amostras de plasma são obtidas antes e 30 e 60 minutos após a injeção EV em bolus de 50 µg. Hormônio liberador de gonadotrofina hipotalâmico. Normalmente, um pico ocorre em 30 minutos, com um aumento de pelo menos 100% para LH e um pouco menos para FSH.
TSH . Tal como acontece com as gonadotrofinas, uma única determinação de TSH permite distinguir um hipotireoidismo primário devido a lesão da glândula tireóide de um secundário devido a uma alteração hipofisária. Um T4 e T3 baixos com HRT elevado confirmam o primeiro diagnóstico, enquanto a falta de TSH aumentado nas mesmas condições indica uma lesão hipofisária. As concentrações normais de TSH variam de 0,5 a 4,5 uU / ml.
Teste HRT . O TSH é quantificado antes e 20 minutos após a administração de 200 µg EV. do hormônio hipotalâmico liberador de TSH, que permite determinar a reserva hipofisária do mesmo. O aumento mínimo é de 8 uU / ml, atingindo valores entre 12 e 25 uU / ml.
Dosagem de prolactina . A dosagem de prolactina é essencial na avaliação endócrina do hipopituitarismo, pois seu aumento é comum nos adenomas hipofisários (60-65%) e nas alterações hipotalâmicas devido à interferência na inibição tônica de sua secreção. Normalmente, as concentrações são inferiores a 25 ng / ml nas mulheres e 20 ng / ml nos homens, em amostras obtidas entre 8 e 10 horas.
Dosagem de ACTH . O ACTH plasmático normalmente apresenta ritmo circadiano, com valores de 50 a 80 picogramas / ml pela manhã e de 10 a 30 picogramas / ml à tarde. A hipoglicemia insulínica é provavelmente o teste mais sensível para avaliar o eixo hipotálamo-hipófise-adrenal. Sua utilidade aumenta, pois o GH e a reserva de prolactina podem ser estabelecidos simultaneamente. O cortisol plasmático é determinado como parâmetro de avaliação antes e 30 e 60 minutos após a administração intravenosa de insulina regular. Em condições normais, há um aumento de pelo menos 7 ng / dl e deve ultrapassar 18 ng / dl.